¿En qué se mide el calor?
La respuesta general, hasta no hace mucho, era “en calorías”. Ahora no es tan general, pero aún hay quien sigue pensando que el calor se mide en calorías.
La caloría se define como la energía que hay que entregar a un gramo de agua para elevar su temperatura desde 14,5^{\circ}C hasta 15,5^{\circ}C. Como se puede observar, en la definición no se dice que ese calentamiento deba hacerse con calor. De la misma forma, se define la frigoría como la energía que cede un gramo de agua al disminuir su temperatura desde 15,5^{\circ}C hasta 14,5^{\circ}C. Caloría o frigoría miden, en definitiva, la misma cantidad de energía, aunque intercambiada en sentido contrario.
El calor (Q) se define como la energía intercambiada como consecuencia de una diferencia de temperaturas en el espacio o, dicho de una forma más académica, como la energía intercambiada como consecuencia de un gradiente de temperaturas. A la energía intercambiada que no es calor se le llama trabajo (W). Como se puede leer, en las definiciones de calor y trabajo aparece una palabra clave: “intercambiada”. ¿Se puede tener calor? Rotundamente no. Se tiene energía. Más energía, menos energía… energía que se puede intercambiar como calor o como trabajo, pero ni el calor ni el trabajo se contienen. ¿Por qué decimos, entonces, “tengo calor”? Pues fácil: porque es más sencillo decir “tengo calor” que decir “mi cuerpo está encontrando dificultades para evacuar la energía que está produciéndose en su interior en las complejas reacciones químicas que están teniendo lugar y, como consecuencia de ello, se está elevando mi temperatura”. Efectivamente, parece más sencillo decir “tengo calor”.
Una forma de trabajo intermedio es el trabajo de rozamiento, siempre presente en todos los procesos físicos reales. El trabajo de rozamiento da lugar a elevaciones de temperatura locales allí donde se intercambia que, a su vez, dan lugar a intercambios energéticos por calor. Pensemos en cuando se lija una madera. En la zona de rozamiento entre el papel de lija y la madera la temperatura aumenta, lo que da lugar a un gradiente de temperatura entre esa zona caliente y el entorno y, por tanto, existirá un intercambio energético por calor. Pero no hay que confundir calor con trabajo. A los ojos del Primer Principio de la Termodinámica, que tan sólo mide balances energéticos, da igual mientras la energía se conserve. Pero… ¿a que no ocurre que aplicando calor a la zona de contacto se mueva la lija sola? Aquí es donde interviene el Segundo Principio de la Termodinámica. No sabemos por qué, desconocemos la razón (como también desconocemos la razón por la que la energía y la masa se conservan, que es el enunciado del Primer Principio, pero por eso son Principios), pero hay sucesos naturales que sólo ocurren en un sentido y nadie ha visto que ocurran en sentido contrario. Y cuando alguien dice haberlo visto… o estaba solo, o no estaba en su sano juicio… o llevaba unas cervezas. De cualquier forma, en estos casos debe intervenir la parapsicología y en esto ya no entramos… al menos aquí.
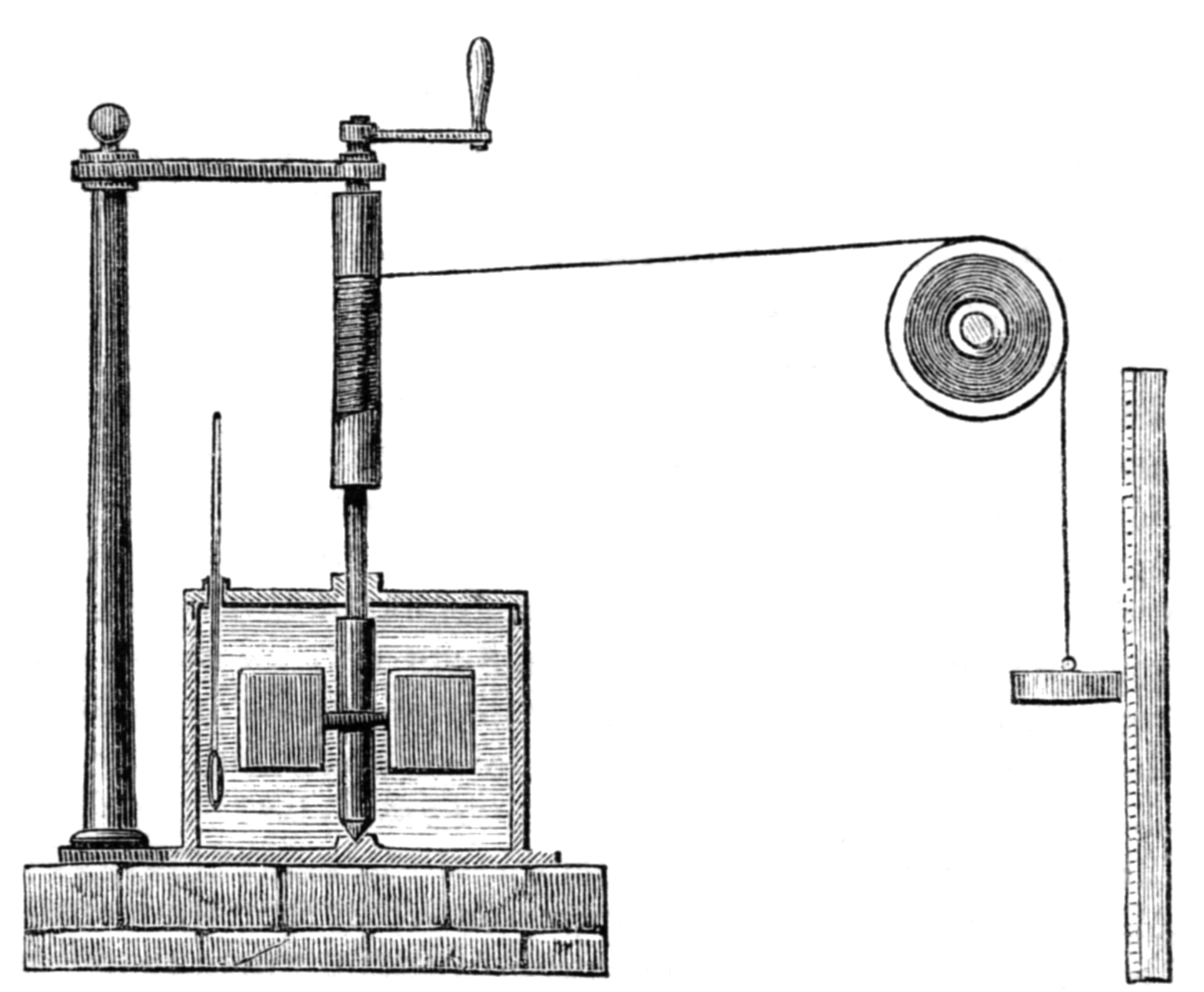
Pues bien: ya hace algunos años (allá por el año 1.849) Joule propuso su más conocido experimento en el que, con un dispositivo que en la actualidad nos sugeriría pensar en algo como una batidora, consiguió elevar la temperatura del agua contenida en un recipiente (calentar) sin aplicar calor. Tampoco se quebró mucho la cabeza, la verdad, para qué engañarnos… pero sí para su época: dejó caer un peso atado a un hilo que, con una polea, hacía girar un rodillo en cuyo eje había dispuesto unas paletas. El agua se calentó (no mucho, pero se calentó) y Joule pensó que si el mismo efecto era producido por causas distintas debía ser que las causas fuesen, de alguna forma, equivalentes. El trabajo intercambiado entre las paletas y el agua es trabajo de rozamiento y calculando la variación de la energía potencial del peso de masa conocida, Joule llegó a la conclusión de que debía haber una unidad distinta a la que hasta entonces se había venido empleando exclusivamente para medir el calor (la caloría). Como él era quien había encontrado la relación, le dio su nombre a esa unidad (mira, para qué andar ahí con más líos…): el Joule o Julio, como hemos la castellanizado. Así, llegó a encontrar la relación entre ambas, que fue lo que se ha dado en llamar el “equivalente mecánico del calor”, que es
1 cal = 4,186 J
Más adelante se propuso la misma relación, pero al revés, lo que es conocido como el “equivalente térmico del trabajo”, que es
1 J = 0,239 cal
Así que desde 1.849 la unidad de calor no es la caloría. O, mejor dicho, sí lo es, pero también lo es el Julio. Pero es que la unidad de trabajo no sólo es el Julio: también es unidad de trabajo la caloría. Pero es que caloría y Julio también son unidades de energía contenida, en general. Qué lío. O no, porque también desde hace unos cuantos años se viene exigiendo la utilización del Sistema Internacional de unidades. La última vez que se nos ha recordado ésto en España ha sido el 30 de diciembre de 2009, cuando se ha publicado el Real Decreto 2032/2009, “por el que se establecen las unidades legales de medida (en España)”. Y, según se escribe ahí, la unidad legal de medida de energía es el Julio (J), sin perjuicio de que se puedan emplear otras (como el kWh, del que más adelante hablaremos, porque anda que…). El Real Decreto lo firma el Rey Juan Carlos I de España y como donde hay patrón, no manda marinero se adapta uno y listo. Y ya sabes que cuanto ante te adaptes, antes dejas de sufrir.
Por tanto, si aún sigues utilizando la caloría como unidad de calor, creo que desde 1.849 has tenido tiempo de actualizarte y de adaptarte. Y si alguien te expresa el calor en calorías, como Ingeniero (o aspirante a ello) debes saber que si te habla en calorías se está refiriendo a calor, pero realmente el calor se mide en J en el Sistema Internacional de Unidades, y no en cal.
Lo dicho. Hay que adaptarse. Va siendo hora.
